Ziyaretçi
Su, Suyun Önemi, Kimyasal ve Fiziksel Özellikleri
Sponsorlu Bağlantılar
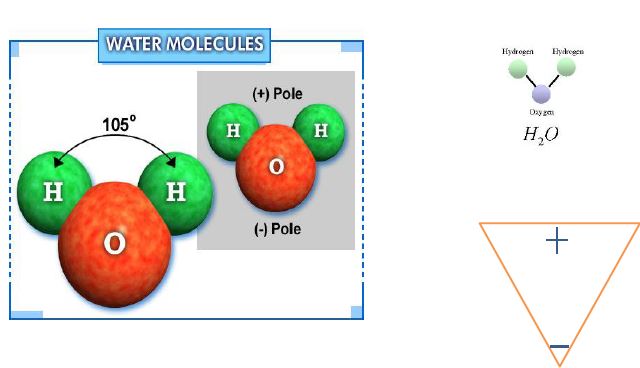
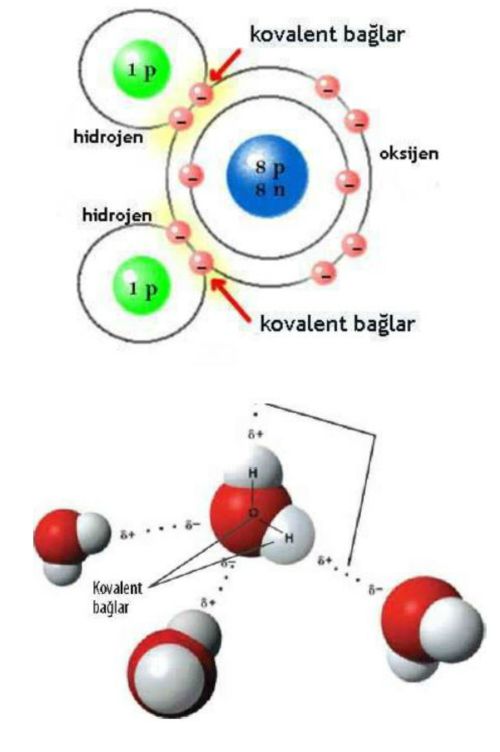
Bu sağlam molekülün bağ kuvveti türü kovalent bağdır.
Atomların çekirdeklerindeki proton sayısı kadar elektron olması; ve ilk bulutsu olasılık bölgesinde en fazla 2 diğerinde ise 4 çift yani 8 elektron olabilmesi; bunların eksikliği durumunun ise o elementin kolay bileşik oluşturmasını sağlar. Çekirdeğinde 8 proton olan oksijen atomunun ikinci elektron bulutunda, ilkinde 2 elektron bulunduğu için 6 elektron vardır. Tek elekronlu iki hidrojen atomu ile bileşik yaptığında dış bulutsulardaki elektronlar ortak kullanılır. ortak elektron kullanımı olan bağlara kovalan bağ denir. Çözmek için bileşim oluşurken ortaya çıkan enerjinin geri verilemesi gerekir.
İşte bu nedenle petrolün tükeneceği yakın gelecekte yerine Hidrojen kullanımının sorunları çözülemedi. Dünyada serbest hidrojen yoktur.
SUYUN FİZİKSEL ÖZELLİKLERİ
İnce tabakalar halindeyken renksiz olan su, derin tabakalar halinde mavi, lacivert renklerdedir. Bunun nedeni güneş ışığının bir kısım renklerinin su tarafından absorplanması (emilmesi) dir.
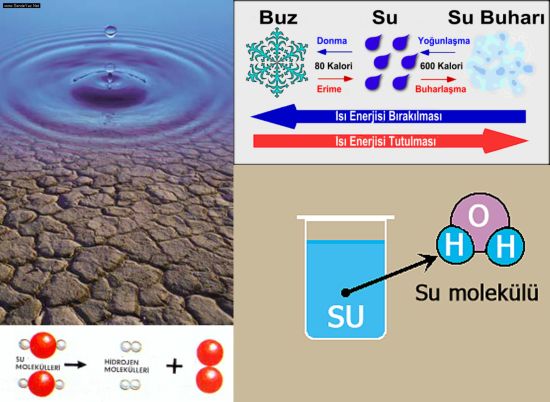
Suyun fiziki özelliklerinden donma ve kaynama noktası, celcius sıcaklık skalası için standart alınmıştır. Suyun donma noktası veya buz, su ve buharın dengede bulunduğu sıcaklık 0°C veya 273.16°K (Kelvin) ve 760 mm.Hg basınca altında suyun kaynama sıcaklığı 100°C olarak kabul edilmiştir.
+3.98°C daki havasız bir kg su 1 lt olarak kabul edilir.Buna göre +3.98°C sıcaklıktaki suyun yoğunluğu l gr/cm³tür.(+3.98°C da su genleşme olarak en büyük değerini alır. Yani bu sıcaklıktaki birim hacimde suyu alır,ısıtır ya da soğutursak diğer, örneğin +20°C daki birim hacimdeki sudan daha fazla oranda genleşir, hacmi artar.
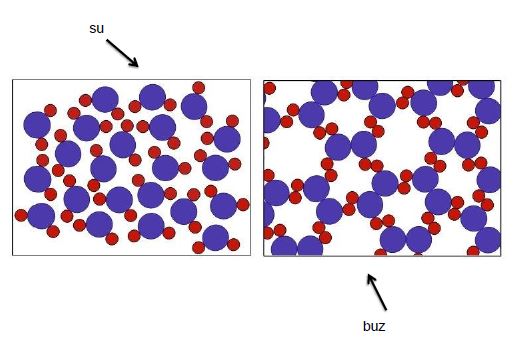
1 gr suyun sıcaklığını 17°C dan 18° C a çıkarmak için verilen ısıya 1 kalori (cal) denir. Su katı, sıvı ve gaz hallerindeyken moleküller özelliklerini korur. Bu nedenle suya belirli ve saf madde denilebilir.
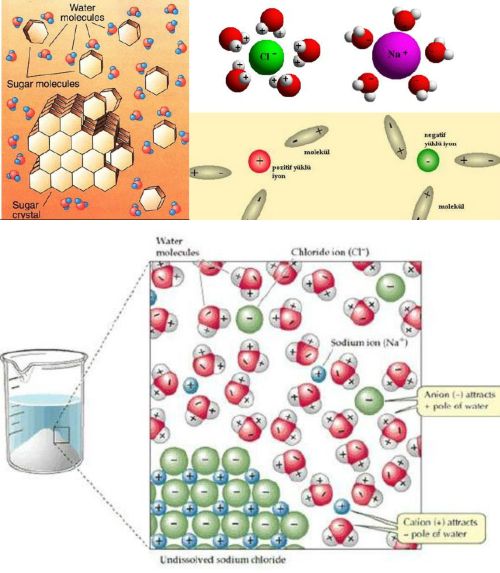
Su 0°C nin altında katı 0°C ile 100°C arasında sıvı ve 100°C nin üzerinde gaz halindedir. Doğada yalnız H O olarak suya rastlamak oldukça güçtür. Çözücü özelliği çok fazla olan su temas ettiği her şeyi az çok çözer. Onlarda beraber bulunur.
SUYUN KİMYASAL ÖZELLİKLERİ
Su oldukça kararlı bir bileşik olduğu için meydana geliş ısısı yüksektir. Metallerle ve ametallerle reaksiyona girerek bunların oksitlerini meydana getirir. Sonuçta hidrojen açığa çıkar.Ametallere örnek
1- C+H O → CO +H2Metallere örnek
2-2Fe+3H O → Fe O + 3HSu halojenlerle reaksiyona girerek bunları indirger ve oksijen açığa çıkarır.
Halojenlere örnek
2H o+2Br → 4HBr + OOksitler su ile reaksiyona girerek hidroksitleri meydana getirir. Bu hidroksitler pozitif yüklü elementin periyodik tablodaki yerine bağlı olarak asidik, bazik veya amfoterik olabilirler.
Su az da olsa iyonlaştığı için zayıf baz veya asit, tuzları suda çözündükleri zaman hidrolize uğrarlar. Metal nitrür suda bozunarak amonyak ve hidrojen açığa çıkar. Metal karbürleri hidrokarbonlar vererek su ile reaksiyona girerler.
CaC + 2H O → Ca(OH) + C HDoğada bulunan suların en safları sırasıyla kar ve yağmur sularıdır. Özellikle yağmur sularında çözünmüş olarak hava içindeki gazlar yanında karbondioksit, klorürler, nitratlar, sülfatlar amonyak ve askıda organik ve anorganik tozlar bulunur. Yağmur suyu içinde çözünmüş halde bulunan amonyak, nitrat ve sülfatlar toprakların zirai gücünü artırır.
Su, bitki ve hayvanların beslenmesinde önemli bir faktördür. Su,çözücü katalizör ve akışkan bir ortam olarak bazı büyüklüklerin tarifinde standart referans maddesi olarak artıkların uzaklaştırılmasında, seyreltici, dağıtıcı, soğutucu, temizleyici, ısı taşıyıcısı olarak bunların yanında hidro-elektrik üretiminde çok yaygın olarak kullanılmaktadır. Sanayide hidrojen suyun elektrolizinden veya su buharı kızgın kömür içerisinden geçirilerek elde edilir.
SUYUN İNSAN HAYATINDAKİ YERİ VE ÖNEMİ
- Vücut hücreleri %55
- Lenf %20
- Kan plazması %7.5
- Kemikler %7.5
- Vücut organlarını ayıran, koruyan
- Destek doku %7.5
- Beyin, omurilik sıvısı %2.5
SUYUN VÜCUTTAKİ GÖREVLERİ
İnsanın susamasıyla suya ihtiyacını belirtir. Lüzumlu olan su o anda alınarak su ihtiyacı giderilir. Bir insan günde yiyecek ve içeceklerle dışarıdan 2.9lt, vücuttaki kimyasal reaksiyonlarla 0.1 lt olmak üzere toplam 3 lt su alır. Buna karşılık kaybedilen su, idrarla l.5 lt, deri yoluyla (terleme şekliyle) 0.9 lt, solunum ile 0.4 lt ve dışkı ile 0.2 lt. dir.
İnsanlar su ihtiyaclarını; meteor suları yer altı suları (kaynak, kuyu ve artezyen) ve yeryüzü sularından (ırmak, göl) karşılarlar.
Dağlık, yüksek bölgelerdeki dere ve göl sularında organik maddeler bulunmamakla birlikte, çözünmüş organik tuzlar vardır.
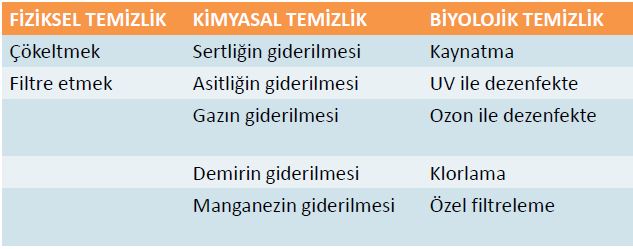
SULARIN TEMİZLENMESİ
Bu temizlenme işlemleri şu şekillerde yapılmalıdır:
1. Suyun içindeki renk, bulanıklık, koku ve kötü tat veren asılı bulunan kolloidal ve çözünmüş haldeki organik ve inorganik zehirli radyoaktif maddeleri ve hastalık yapan mikropları yok etmek.İçme suyunun temizlenmesinde uygulanan temel işemler:
2. Demir ve mangan gibi metalleri gidermek.
3. Sertliği ve sıcaklığı normal hale getirmek.
4. Asitliği ve bazlığı nötrleştirmek, aşındırıcı bilhassa kurşun çözündürücü ve birikinti meydana getirici özelliği yok etmek.
1. Havalandırma
2. Havuzlama
3. Kabasını alma
4. Basit çökeltim
5. Pıhtılaşmış yumaklı çökeltim
6. Suların kum süzgeçlerden geçirilmesi
- Yavaş süzen kum süzgeçleri
- Çabuk süzen süzgeçler
- Küçük süzgeçler
Suların mikroplardan temizlenmesi1. Kaynatma
2. Ultraviole ile dezenfeksiyon
3. Ozonla dezenfeksiyon
4. Klor dezenfeksiyonu
5. Kireç kaynağı ile dezenfeksiyon.
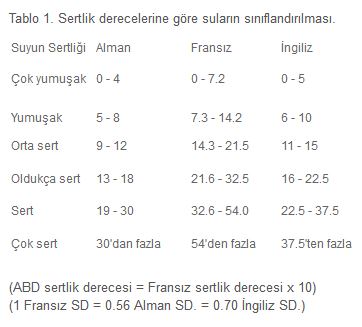
SULARIN SERTLİĞİ
Sularda çeşitli bileşikler çözünür bunlar mg/l olarak ölçülür,kalsiyum karbonat, kalsiyum oksit veya kalsiyum cinsinden ifade edilip toplanabilir. Bu çözülen bileşiklerden özellikle kalsiyum, mağnezyum gibi iki oksidasyon değerli iyonlar, sabunun köpürme kudretini azaltır, sıcak su borularında, ısıtıcılarda, buhar kazanlarında ve suyun temperatürünü yükseltmek için kullanılan kaplarda taş bağlanmasına sebep olur. Bu iyonların sabunla köpürmeye karşı direnme özelliğine sertlik denir. Buna göre, sabun sertliği ölçmek için bir ölçek olabilir.
sabun sudaki sertlik çökelti
2C17 H35 COONa + M++ = (C17H35COO)2 M + Na +Denklemde görüldüğü üzere, su sertliğini veren iyonları, sabun bünyesine alıp çökeltdikten sonra köpürmeye başlar. Buna göre,suda ne kadar iki değerli iyon fazla ise, diğer bir ifade ile suyun sertliği ne kadar çok ise, sabun sarfiyatı çok ve sıcak su borularında ve buhar kazanlarında taş bağlama olayı o kadar fazla olacaktır. Gerek sabun sarfiyatı, gerekse suların temperatür değişimi ile taş bağlaması , ekonomik ve ısıtma, temizleme işlerini zorlaştırması bakımından, su sertliği üzerinde durmaya değer.
SERTLİĞİN SEBEPLERİ
Sertliğe iki valanslı metalik katyonlar sebep olur. Bu iyonlar, özellikle Ca ,Mg ve bir dereceye kadar Sr ,Fe ve Mn iyonlarıdır. Suda çözünen bileşiklerin katyonları ile onyonları dengede olacağı da göz önünde tutulursa katyonların toplam ekivalant adedi,anyonların toplam ekivalant adedine eşit olur.
Sertliğe sebepolan
Katyonlar: Ca . Mg . Sr . Fe .MnSuyun sertliğini veren katyon ve bunlarla dengede olan anyonlar.
Anyonlar : HCO3-- . SO4-- . Cl - . NO3- . SLO3--
Toprağa düşen yağmur suları tabii sularda bulunan çok miktardaki solitleri çözmeye kudreti kafi gelmez. Suyun bu çözücülük özelliği topraktaki bakterilerin etkisi ile hasıl olan karbondioksidin suya karışarak, suda karbonik asit iyonlarını hasıl etmesinden ileri gelir.
CO2 + H2O ----------- H2 CO3 -----------H+ + HCO3-Bakteri etkisi Yağmur suyuile hasıl olur.
Genel olarak sert sular, üst toprağın yoğun olduğu ve kalker bulunan yerlerden çıkar. Buna karşılık yumuşak sular da daha ziyade üst toprağın gevşek olduğu ve kalker teşekkülü az veya hiç olmayan yerlerde mevcut olur.
Suların sert olması, insan sağlığına hiçbir etki yapmaz. Temizlik işlerinde sabun sarfiyatı bakımından uygun değildir.
SU SERTLİKLERİNİN SINIFLANDIRILMASI
Su sertlikleri bulundukları yerin Jeolojik yapılarına göre değişir. Yüzey suları, yer altı sularından daha yumuşaktır. Su sertlikleri 10ppm CaCO3 den takriben 1800 ppm CaCO3 kadar değişiklik gösterir.
Suların sertlik dereceleri şöyle sınıflandırılabilir:
- 0 75 ppm CaCO3 yumuşak
- 76 150 ppm CaCO3 orta sert
- 151 300 ppm CaCO3 sert
- 300 den yukarısı ppm CaCO3 çok sert
DURULMA İŞLEMLERİ
Durulma sularda süspansiyon halinde bulunan organik ve anorganik orjinli değişik büyüklükteki maddelerin çöktürülerek ayrılması sonucu suyun berraklaşması olayıdır. Durulma işlemi su içerisinde bulunan değişik büyüklükteki maddelerin kendi ağırlıkları ile çöktürülmesi şeklinde yapılıyorsa buna mekanik durulma işlemi adını veriyoruz. Dışarıdan herhangi bir çöktürücü madde ilavesiyle bir durulma yapılıyorsa buna da kimyasal durulma işlemi denir. Durulma işlemi denir. Durulma işlemi nehir ve göl sularının doğal olarak temizlenmesinde önemli rol oynamaktadır. Diğer taraftan kullanma suları sanayi Suları ve atık suların değerlendirilmesi için en çok kullanılan işlem durulma işlemidir. Gerek içme ve gerekse sanayi sularının temizlenmesinde kullanılan basit mekanik durulma en ucuz ve en sade işlemlerden biridir. Doğal sedimantasyon işlemi daha sonrada yapılacak temizleme işlemlerindeki yükü hafifleten ön bir işlem gözüyle bakılabilir. Örneğin daha sonra yapılacak işlem kimyasal durulma işlemi olacaksa, ön durulma işlemi yapılmış suya ilave edilecek kimyasal madde ile durulma işlemine tabi tutulmamış suya ilave edilecek madde miktarı karşılaştırılacaksa ikinci durumdaki sarfedilen kimyasal madde oldukça fazla olacaktır. Diğer bir avantajıda kimyasal durulmada kullanılan cihazda atılacak atıklarda, azalmış olacaktır. Su içerisinde bulunan bir partikülün çökme ile durulma havuzunun dibine ulaşması belirli bir zaman alacaktır. Bu zaman yatay bir havuzda akış hızını azaltarak, ya da akış süresini uzatarak veyahut havuzun derinliğini ayarlayarak suyun havuzu terketmesinden önce partikülün çökmesi sağlanabilir. Bunun için en uygun havuzlar fazla derin olmayan havuzlardır. Durulma havuzlarında bir partikülün çökme hızı hesaplanabilir.
- V = Q . t V= Havuzun hacmi Q= Suyun debisi
- T= suyun havuzda kalma süresi
KİMYASAL DURULMA
Özellikle yeryüzündeki sular değişik miktarlarda süspansiyon halinde kaba büyük tanecikler halinde bulanıklık veren ve renk verebilen değişik tip kalloidal meddeleri ihtiva ederler. Doğal sularda bulanıklığı meydana getiren başlıca maddeler farklı tipkolloidal killerdir. Kullanma ve sınai atık sularının karışmasıyla meydana gelen kolloidler, yosunlar, bozunma ürünleri, bakteriler, bazı organik maddeler ve renk verici kolloidlerdir. Bu kollaidlerden bazıları hidrofobik, bazılarıda hidrofilik özelliklerdir. Bulanıklığı meydana getiren partiküllerin büyüklükleri çok farklı olabilmektedir.Kimyasal durulma işlemini dört kademeye ayırabiliriz:
Katılan kimyasal maddelerin suyla hızlı bir şekilde ve tamamen karışması ikinci kademede gerçekleştirilir. Üçüncü kademede ise dikkatli ve yavaş bir karıştırma yapılarak çekirdeklerin oluşumu sağlanır. Dördüncü kademede büyüyen çekirdeklerin çökmesi ile durulma işlemi gerçekleştirilir. Durulma işlemi sonucu suda kalmış olan az miktardaki çökelek daha sonra filtrasyon işleminde tamamen giderilir.
- Kimyasal maddenin ilave edilmesi
- Hızlı bir karıştırma
- Flokasyon
- Çökme-Durulma
FİLTRASYON
Toprak altına geçen sularda doğal bir filtrasyon olur. Bizde bu olayı taklit ederek sularda bir filtrasyon işlemi gerçekleştirebiliriz. Ençok kullanılan filtrasyon maddesi kum dur.Daha sonra antrasit, taşkömürü ve kiselgur olabilir. Filtreleri çalışmaları bakımından hızlı süzen filtreler ve yavaş süzen filtreler olmak üzere iki gruba ayırabiliriz.Süzme işleminde suların arıtılması şu şekilde olur.
1. Doğrudan doğruya süzme: Bir kum tabakasından geçen suda kumlar arasındaki boşluktan daha büyük tanecikler varsa bu tanecikler kum yüzeyinde tutulur.
2.Durulma: Kum tabakasını birçok tabakalara sahip durulma havuzu gibi düşünebiliriz. Süspansiyon halindeki taneciklerin birleşerek daha büyük tanecikler haline geçmesi ve filtrasyonla daha kolay ayrılması.
3.Biyolojik aktivite: Bu daha ziyade yavaş süzen filtrelerde önemlidir. Ancak maliyetin yüksek olması nedeniyle geniş ölçüde kullanılamaz.
BAKINIZ
Hidrojen Bağı
Besin Ögesi Olarak Su ve Beslenmedeki Önemi
Elementler - Hidrojen
Elementler - Oksijen
Son düzenleyen Safi; 14 Mart 2017 00:41

 Su, Suyun Önemi, Kimyasal ve Fiziksel Özellikleri
Su, Suyun Önemi, Kimyasal ve Fiziksel Özellikleri