Ziyaretçi
8A Grubu Elementleri / Asal Gazlar/ Soygazlar
soy gazlar, asal gazlar olarak da bilinir, periyodik tablonun 8 grubunu oluşturan altı kimyasal element.
Sponsorlu Bağlantılar
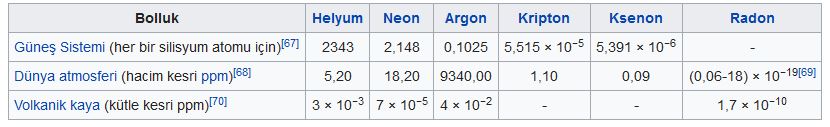
Soy gazların hepsi Yer atmosferinde bulunur ve atom numaraları arttıkça bollukları azalır. Helyum hidrojenden sonra evrende en çok bulunan ikinci elementtir ve evrenin toplam kütlesinin yaklaşık yüzde 25iııi oluşturur. Helyum ve radon dışındaki soy gazlar başlıca, sıvı havanın ayrımsal damıtılması yoluyla elde edilir.
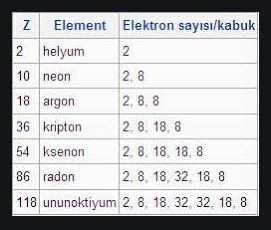
Soy gazlar normal koşullarda renksiz, kokusuz ve yanmayan gazlardır. Atomları çok kararlı bir elektron yapısına sahip olduğundan elektron alıp vermezler ve başka elementlerle çok ender olarak elektron paylaşırlar. Bu nedenle bazen eylemsiz gaz olarak da adlandırılırlar. Ama 1962de soy gazların en ağırları olan kripton, ksenon ve radonun, elementler arasında elektron çekme yeteneği en güçlü olan flüorla kimyasal bileşikler oluşturabildiği bulundu. Bu üç soy gaz atomunun en dış kabuğundaki elektronlar daha gevşek tutulduklarından helyum, neon ve argonunkilere göre daha kolayca uzaklaştırılabilirler.
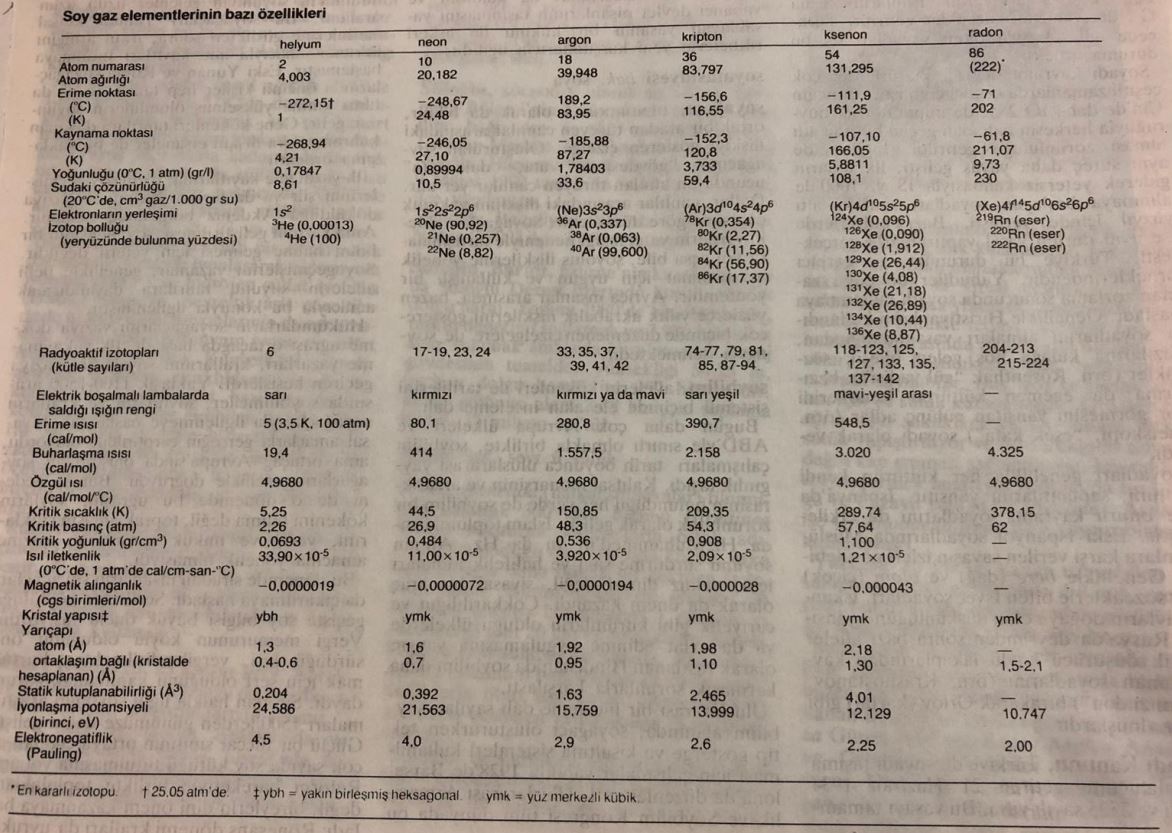
Soy gazlar elektromagnetik ışınımları öbür maddelere göre daha yalın biçimde soğurur ve salarlar. Düşük basınç altında bir cam tüp içindeki soy gazdan elektrik akımı geçirildiğinde gaz parlak bir ışık salar. Bu nedenle çok radyoaktif olan radon dışındaki soy gazlar flüoresan lambalarda ve elektrik panolarında kullanılır. Ayrıca erime ve kaynama noktaları çok düşük olan soy gazlardan kriyojeni (düşük sıcaklıklar fiziği) alanında soğutucu olarak da yararlanılır.
kaynak: Ana Britannica
BAKINIZ
Elementler - Helyum
Elementler - Neon
Elementler - Argon
Elementler - Kripton
Elementler - Ksenon
Elementler - Radon
Elementler - Helyum
Elementler - Neon
Elementler - Argon
Elementler - Kripton
Elementler - Ksenon
Elementler - Radon
Son düzenleyen Safi; 22 Eylül 2019 02:15

 8A Grubu Elementleri (Asal Gazlar, Soygazlar)
8A Grubu Elementleri (Asal Gazlar, Soygazlar)