Ziyaretçi
pH Değeri
Vikipedi, özgür ansiklopedi
pH teriminde p; eksi logaritmanın matematiksel sembolünden ve H ise hidrojenin kimyasal formülünden türetilmişlerdir. 0'dan 14'e kadar olan bir skalada ölçülür.
pH tanımı, hidrojen konsantrasyonunun eksi logaritması olarak verilebilir:
Bir maddenin pH değeri hidrojen iyonu [H+] ile hidroksil iyonunun [OH−] derişimlerinin oranına direk bağlıdır:
Vikipedi, özgür ansiklopedi
Sponsorlu Bağlantılar
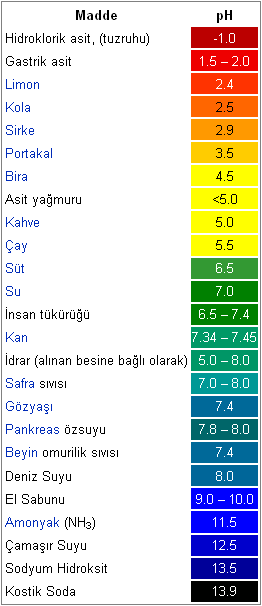
Bazı maddelerin pH değerleripH bir çözeltinin asitlik veya bazlık derecesini tarif eden ölçü birimidir. Açılımı "Power of Hydrogen" dir (Hidrojenin Gücü).
pH teriminde p; eksi logaritmanın matematiksel sembolünden ve H ise hidrojenin kimyasal formülünden türetilmişlerdir. 0'dan 14'e kadar olan bir skalada ölçülür.
pH tanımı, hidrojen konsantrasyonunun eksi logaritması olarak verilebilir:
pH = −log[H+]pH hidrojen iyonun aktivitesi cinsinden bir asit veya bazın derecesini ifade etme yoluyla ihtiyaç duyulan kantitatif (niceliksel) bilgiyi sağlar.
Bir maddenin pH değeri hidrojen iyonu [H+] ile hidroksil iyonunun [OH−] derişimlerinin oranına direk bağlıdır:
- Eğer H+ derişimi OH− derişiminden fazla ise çözelti asidik; yani pH değeri 7'den düşüktür.
- Eğer OH− derişimi H+ derişiminden fazla ise maddemiz bazik; yani pH değeri 7'den büyüktür.
- Eğer OH− ve H+ iyonlarından eşit miktarlarda mevcutsa, madde 7 pH değerine sahip olmak üzere nötrdür.

 pH Değeri
pH Değeri