Hidrojen sülfür

Anorg. Formülü H2S olan asit.
Sponsorlu Bağlantılar
Hidrojensülfür anyonu, bir hidrojen atomu içeren sülfür.
Anal. kim. Hidrojensülfür ölçümü, özellikle suda bulunan hidrojensülfürü hacim- ölçümsel olarak belirleme (Hidrojensülfür ölçümü, şöyle yapılır: hidrojensülfür çözeltisine gereğinden çok katılan ayarlı iyot çözeltisi, hidrojensülfürün tümüyle parçalanmasından sonra nişastayı maviye boyar. Kullanılan iyodun santimetreküp değerinden kükürt oranı saptanır.)
ANSİKL. Anorg. kim. Hidrojensülfürü 1773'te Rouelle buldu; Scheele ise bileşimini ortaya koydu.
Hidrojensülfür, bozuk yumurta kokusunu andıran pis kokulu, renksiz bir gazdır. Yoğunluğu 1,2 olan bu gaz, -60,7 °C'ta sıvılaşın Normal koşullarda 1 litre suda 3 litresi çözünür. Aşırı derecede zehirlidir; lağım çukurlarından çıkan gazların yol açtığı zehirlenmelerin büyük bir bölümü hidrojensülfür yüzünden meydana gelir (lağımcı baygınlığı). Bir yerde bulunup bulunmadığı demir II sülfat ya da çinko klorürle anlaşılır.
Az kararlı olan hidrojensülfür, ısıtıldığında kolayca bozunur. Bileşenlerinin özelliğine bağlı olarak indirgeyici ve sülfürleyici bir niteliği vardır. Halojenlerle bozunur, yandığında su buharı ve kükürt dioksit verir. Ancak oksijenin yeterli olmadığı koşullarda, kükürt serbest duruma geçer. Bu nedenle çözeltileri havayla temas ettiğinde kükürdün çökelmesi sonucu bulanır. Ilık çözeltileri, katalizör rolü oynayan gözenekli cisimlerle sülfürik aside dönüşür. Hidrojensülfür, sıcakta metallere etkiyerek sülfür ve hidrojen verir.
Hidrojensülfür, zayıf bir diasittir. Alkalilere etkiyerek iki seri tuz oluşturur. Bunlar NaHS gibi hidrojensülfürler ile yanlış olarak yansız sülfürler denen NajS gibi gerçek sülfürlerdir. Hidrojensülfür, metal sülfürlerinin çoğu çözünmediğinden metalsel tuz çözeltisiyle çoğu kez özgün farklı renklerde çökeltiler meydana getirir.
Hidrojensülfür, volkanik fümerollerden ve kimi mineral kaynaklardan serbestçe açığa çıkar. Ayrıca hayvansal maddelerin (dışkı, yumurta, et vb.) çürümesi sonunda da oluşur.
Hidrojensülfür, kimyasal çözümlemede kullanılır. Tıpta, solunum yolları hastalıklarında kükürdün uyarıcı özelliklerinden yararlanılır, ayrıca, termal suların bileşiminde bulunur (Eaux-Bonnes).
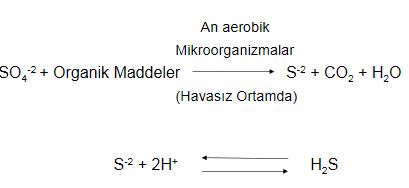
Hidrojensülfür üretimi
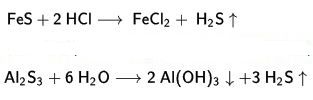
kimyasal özellikler

BAKINIZ
Elementler - Hidrojen
Elementler - Kükürt
Son düzenleyen Safi; 14 Mart 2017 03:31
"İnşallah"derse Yakaran..."İnşa" eder YARADAN.

 Bileşikler - Hidrojen Sülfür
Bileşikler - Hidrojen Sülfür