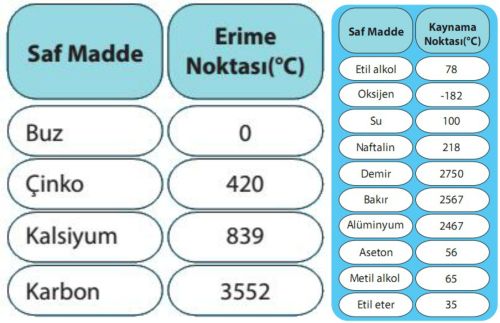
kaynama noktası
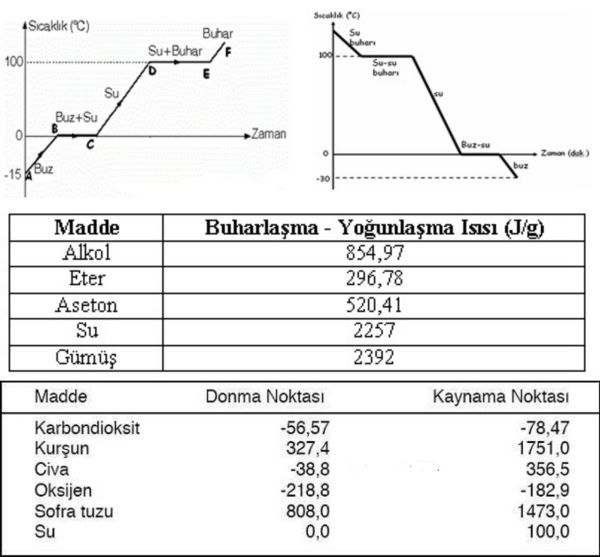
sıvılarda, çevrenin sıvı üzerinde etkidiği basınç ile sıvının buhar basıncının eşitlendiği sıcaklık. Bu durumda ısı artışı, sıcaklığında yükselme olmaksızın sıvının buhara dönüşmesine neden olur.
Sponsorlu Bağlantılar
Belirli bir sıcaklığın üstünde sıvı, yüzeyinde atmosfere doğru kısmen buharlaşır; bu süreç, buharın etkidiği basınç, sıvının o sıcaklıktaki buhar basıncı denen karakteristik bir değere ulaşmasına kadar sürer. Sıcaklık yükseldikçe buhar basıncı da artar; kaynama noktasında, sıvı içinde oluşan buhar kabarcıkları yüzeye çıkar. Bir sıvının kaynama noktası, üzerinde etkiyen basınca bağlı olarak değişir; normal kaynama noktası, buhar basıncının deniz düzeyindeki standart atmosfer basıncına (760 mm cıva basıncı) eşit olduğu sıcaklıktır. Deniz düzeyinde su 100°Cde kaynar. Daha yüksek yerlerde kaynama noktası sıcaklığı daha düşüktür.
buharlaşma
bir maddenin sıvı ya da katı fazdan gaz (buhar) fazına dönüşmesi. Eğer sıvı içinde buhar kabarcıkları oluşursa bu sürece kaynama, madde katı fazdan doğrudan doğruya buhara dönüşürse süblimleşme (uçunum) denilir.
Buharlaşmaya yol açmak için katı ya da sıvıya ısı eklemek gerekir. Bir sistemde çevre, buharlaşma için yeterli ısıyı veremiyorsa, sistemin kendisi kısmen soğuyarak bu ısıyı sağlayabilir (örn. karpuzu kesip açıkta bırakmak, testiye ıslak tülbent sarmak). Bir katı ya da sıvının atomları ya da molekülleri, kohezyon kuvvetlerinin etkisiyle bir arada tutulur ve buharın oluşması için bu kuvvetlerin üstesinden gelerek atomları ya da molekülleri birbirlerinden ayırmak gerekir. Buharlaşma ısısı, bu kohezyon kuvvetlerini yenmek için harcanması gereken enerjinin ölçüsüdür.
Bir buharın yoğunlaşarak sıvı ya da katı oluşturması da buharlaşmanın tersidir. Bu süreçte ise yoğunlaşan buhardan çevreye ısı aktarılmalıdır. Bu ısının miktarı, değer olarak buharlaşma ısısına eşittir; bu nedenle de buharlaşma ısısı gibi, söz konusu maddenin belirleyici özelliklerinden biridir.
süblimleşme
UÇUNUM olarak da bilinir, bir maddenin katı halden sıvı hale geçmeden doğrudan doğruya gaz (buhar) haline dönüşmesi. Kuru buzun (donmuş karbon di- oksit) atmosfer basıncında ve normal sıcaklıkta buharlaşması süblimleşmeye bir örnektir. Süblimleşme, buhar basıncı ile sıcaklık arasındaki bağıntıdan kaynaklanır. Besinlerin dondurularak kurutulmasında, suyun donmuş haldeki besinden yüksek vakum altında süblimleştirilmesi işlemi uygulanır. Ayrıca bak. buharlaşma; faz diyagramı.
faz diyagramı
bir maddenin ya da karışımın katı, sıvı ve gaz hallerinin, basınç ve sıcaklık ya da çözünürlük ve sıcaklık gibi çeşitli termodinamik parametrelere bağlı karşılıklı denge konumlarını gösteren grafik. Çizimde, tek bileşenli (tek bir katışkısız maddeden oluşan) bir sistemin tipik bir faz diyagramı görülmektedir. Eğriler, değişik basınç ve sıcaklıklarda yapılan ölçümlerden elde edilmiştir. Bu eğrilerle ayrılan alanlar içinde kalan basınç ve sıcaklık koşullarında yalnızca tek bir faz (katı, sıvı ya da gaz) bulunur. Sıcaklık ve basınç değişimleri eğrilerin üzerindeki noktalara ulaşmadıkça bu faz değişmez. Eğrilerin üzerinde yer alan herhangi bir basınç ve sıcaklık noktasında, katı-sıvı, katı-buhar ya da sıvı-buhar gibi iki farklı faz denge halinde bulunur. Örneğin, sıvının buhar basıncının sıcaklıkla değişimini gösteren eğri, sıvı ve buhar fazları arasında bir sınır oluşturur. Düşük sıcaklık ve yüksek basınç tarafında sıvı olan madde, eğrinin ancak yüksek sıcaklık ve düşük basınç tarafında buhar olarak bulunabilir.
Eğrinin üzerindeki noktalara denk düşen basınç ve sıcaklıklarda, sıvı ve buhar fazları birlikte bulunur; bu eğrinin yok olduğu kritik noktada, sıvı ve buhar birbirinden ayırt edilemez duruma gelir. Sıvı ve katı arasındaki eğri boyunca farklı basınçlar için erime sıcaklıkları bulunabilir. Üç eğrinin kesiştiği üçlü nokta üç fazın da dengede bulunduğu tek durumdur. İki bileşenli bir alaşımın faz diyagramı, çoğunlukla sıcaklık- bileşen diyagramı üzerindeki erime eğrilerini gösterir.

Her maddenin ve .karışımın kendine özgü bir faz diyagramı vardır. Karmaşıklar, üç boyutlu faz diyagramların, gereksinim gösterebilir; bu durumda, bu diyagramlar perspektif yardımıyla iki boyutta gösterilir. Minerallerin ve kayaçlann Yer içindeki oluşum koşullarına bağlı olarak mineral dengelerinin incelenmesinde faz diyagramlarından yararlanılır. Bu diyagramlar ayrıca, sanayi donanımlarının tasarımında, üretim işlemlerinin optimum koşullarının araştırılmasında ve maddelerin arılıklarının belirlenmesinde de büyük önem taşır.
kaynak: Ana Britannica
Son düzenleyen Safi; 17 Ağustos 2016 18:25
In science we trust.

 Kaynama Noktası Nedir?
Kaynama Noktası Nedir?