Ziyaretçi
Pil hakkında geniş bilgi verir misiniz?
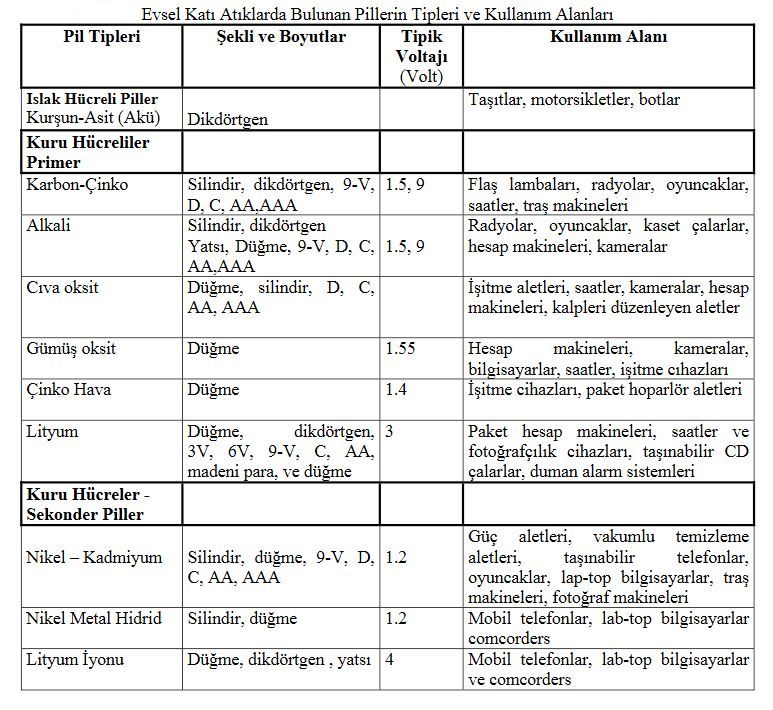
Pillerin özellikleri
Piller, kimyasal enerjiyi elektrik enerjisine dönüştüren, kompleks elektro kimyasal aletlerdir. Pil hücresi, metal anot (negatif elektrot), metal oksit katyon (pozitif elektrot) ile iki elektrot arasında kimyasal reaksiyonu sağlayan elektrolitten ibarettir. Anot, elektrolizde aşınırken katotta iyonik değişim reaksiyonu sonucu elektrik akımı meydana gelir. Bu reaksiyon sonucu oluşan elektrik enerjisi çeşitli aletlerde kullanılır. Her bir hücre genel olarak 1.5 volttur. Hücreler birbirine seri bağlanarak daha yüksek voltaj üretebilir. Örneğin, 9 volt pil, 6 adet 1.5 v hücrenin seri halde bağlanması sonucu elde edilir. Elektro kimyasal sisteme bağlı olarak hücre voltajı 1.2 v ile 4 v arasında değişir.
Piller, ıslak veya kuru olarak ikiye ayrılır. Islak hücreli pillerde, elektrolit sıvıdır. Kuru hücreli pillerde elektrolit, pasta, jel veya diğer matrix halde bulunur. Primer pillerde, reaksiyon hücre içinde gerçekleşir ve reaksiyon tersinmezdir. Primer piller şarj edilemez.
Seconder pillerde kimyasal reaksiyonlar tersinirdir. Dıştan bir enerji ile reaksiyon başa döndürülür. Güç, sekonder kaynaktan pile yüklenebilir.
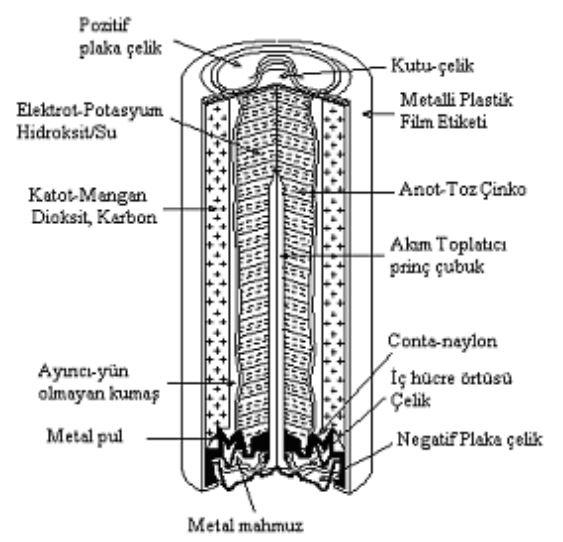
Alkali Piller
Alkali pillerin anodunda yüksek-yüzey alanlı çinko tozu, katodunda ise yüksek kaliteli mangan dioksit (MnO2) bulunmaktadır. Elektroliti pelteleştirmek için bir selüloz türevi kullanılır. Elektrolit, potasyum hidroksittir. Alkali piller, aktif katot maddesi olarak cıva oksit (HgO) veya gümüş oksit (Ag2O) gibi maddeleri de kullanılır.
Pil hücresinde enerji üretimi için gerçekleşen reaksiyonu,
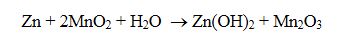
Alkali pillerde 1985 yılında pilin ağırlığının %1i oranında cıva bulunurken bugün (2000 yılı) bu değer %0.025-0.0001 oranına düşürülmüştür. Alkali pillerin her birin de 25 mg.dan fazla cıva olması istenmez. Son zamanlarda özellikle cıva içermeyen alkali pilleri üzerinde yoğun çalışmalar devam etmektedir. Cıvaya ilaveten alkali piller kurşun, kadmiyum, arsenik, krom, bakır, indiyum, demir, nikel, kalay, çinko ve magnezyum gibi metalleri de içermektedir.
Kullanılmayan alkali piller kuru ve soğuk yerde depolanmalı. Alkali pil kullanılan cihaz 30 günden fazla çalıştırılmıyorsa pili cihazda tutup deşarj olmasına neden olunmamalıdır.
Alkali pillerde verilen sınır değerlerinin üzerinde ağır metal olması istemez.
DEVAMI Pil Nedir? Pilin Özellikleri ve Yapısı Hakkında
Piller, kimyasal enerjiyi elektrik enerjisine dönüştüren, kompleks elektro kimyasal aletlerdir. Pil hücresi, metal anot (negatif elektrot), metal oksit katyon (pozitif elektrot) ile iki elektrot arasında kimyasal reaksiyonu sağlayan elektrolitten ibarettir. Anot, elektrolizde aşınırken katotta iyonik değişim reaksiyonu sonucu elektrik akımı meydana gelir. Bu reaksiyon sonucu oluşan elektrik enerjisi çeşitli aletlerde kullanılır. Her bir hücre genel olarak 1.5 volttur. Hücreler birbirine seri bağlanarak daha yüksek voltaj üretebilir. Örneğin, 9 volt pil, 6 adet 1.5 v hücrenin seri halde bağlanması sonucu elde edilir. Elektro kimyasal sisteme bağlı olarak hücre voltajı 1.2 v ile 4 v arasında değişir.
Sponsorlu Baglantilar
Seconder pillerde kimyasal reaksiyonlar tersinirdir. Dıştan bir enerji ile reaksiyon başa döndürülür. Güç, sekonder kaynaktan pile yüklenebilir.

Alkali Piller
Alkali pillerin anodunda yüksek-yüzey alanlı çinko tozu, katodunda ise yüksek kaliteli mangan dioksit (MnO2) bulunmaktadır. Elektroliti pelteleştirmek için bir selüloz türevi kullanılır. Elektrolit, potasyum hidroksittir. Alkali piller, aktif katot maddesi olarak cıva oksit (HgO) veya gümüş oksit (Ag2O) gibi maddeleri de kullanılır.
Pil hücresinde enerji üretimi için gerçekleşen reaksiyonu,
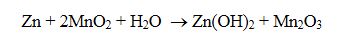

Alkali pillerde 1985 yılında pilin ağırlığının %1i oranında cıva bulunurken bugün (2000 yılı) bu değer %0.025-0.0001 oranına düşürülmüştür. Alkali pillerin her birin de 25 mg.dan fazla cıva olması istenmez. Son zamanlarda özellikle cıva içermeyen alkali pilleri üzerinde yoğun çalışmalar devam etmektedir. Cıvaya ilaveten alkali piller kurşun, kadmiyum, arsenik, krom, bakır, indiyum, demir, nikel, kalay, çinko ve magnezyum gibi metalleri de içermektedir.
Kullanılmayan alkali piller kuru ve soğuk yerde depolanmalı. Alkali pil kullanılan cihaz 30 günden fazla çalıştırılmıyorsa pili cihazda tutup deşarj olmasına neden olunmamalıdır.
Alkali pillerde verilen sınır değerlerinin üzerinde ağır metal olması istemez.
DEVAMI Pil Nedir? Pilin Özellikleri ve Yapısı Hakkında
Son düzenleyen Safi; 11 Haziran 2016 17:24

 Pil hakkında geniş bilgi verir misiniz?
Pil hakkında geniş bilgi verir misiniz?
