Ziyaretçi
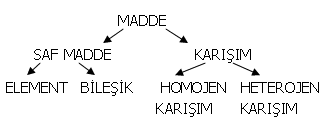
ELEMENT
a. (fr. ülâment'dan). Valin aynı bir cismin hem çeşitli türlerinde hem de bu yalın cismin diğer cisimlerle oluşturduğu bileşiklerde yer alan kimyasal ortak temel madde (Bk. ansikl. böl Biyol., Kim., Tarım.)
Sponsorlu Bağlantılar
Kim. Elementlerin dönemli sınıflandırılması (ya da tablosu), kimyasal elementlerin atom numaralanna göre dönemli olarak değişen kimyasal ya da fiziksel özellikleri arasındaki benzerlikleri sıra ve kolonlar halinde gösteren dağılım. (Bk. ansikl. böl.)
♦ sıf. Kim. Elementle ilgili, elemente ilişkin. ll Element çözümlemesi, arı bir cismi, kendisini oluşturan elementleri belirlemek (nitel ya da nicel olarak) üzere çözümleme.
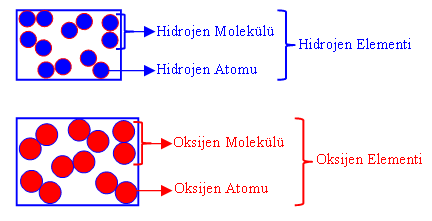
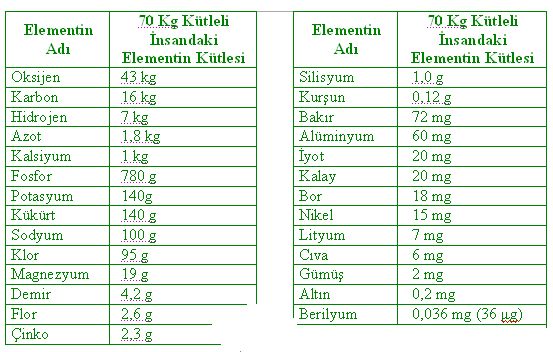
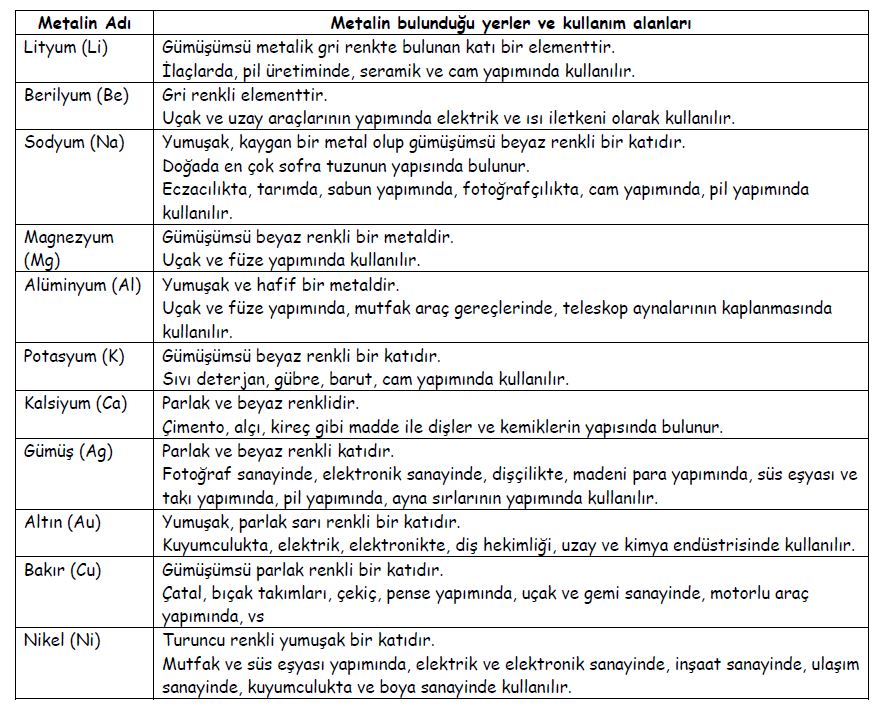
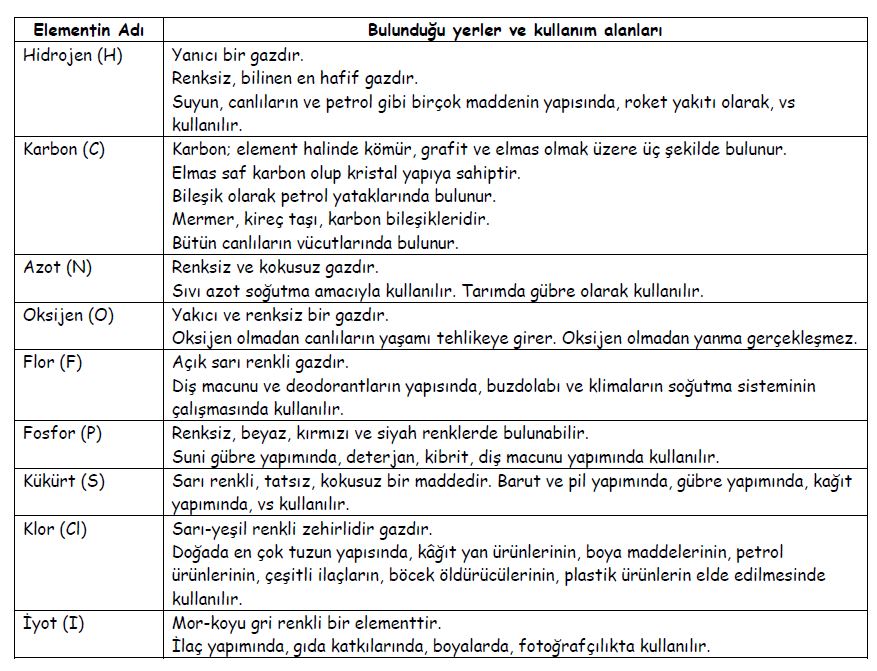
ANSİKL. Biyol. Tüm organizmalarda 27 basit cismin sürekli bulunduğu kabul edilir: 11 metal olmayan (karbon, hidrojen, oksijen, azot, kükürt, fosfor, klor, flüor, brom, iyot, bor), 2 yarı metal (silisyum, arsenik) ve 14 metal (kalsiyum, sodyum, potasyum, magnezyum, demir, çinko, bakır, nikel, kobalt, manganez, alimünyum, kurşun, titan, kalay). Bazı canlı varlıklarda, varlığı sürekli olmayan bazı elementler de bulunmuştur (vanadyum, rubidyum, sezyum, molibden, baryum, stronsiyum, gümüş ve krom). Plastikler denen 11 elementse çok boldur (karbon, hidrojen, oksijen, azot, kükürt, fosfor, klor, sodyum, potasyum, kalsiyum, magnezyum). Ancak iz halinde bulunabilen öteki elementler katalizör rolü oynar ya da özel fizyolojik bir sürece katılırlar: G. Bertrandın deyimiyle bunlara oligoelementler denir.
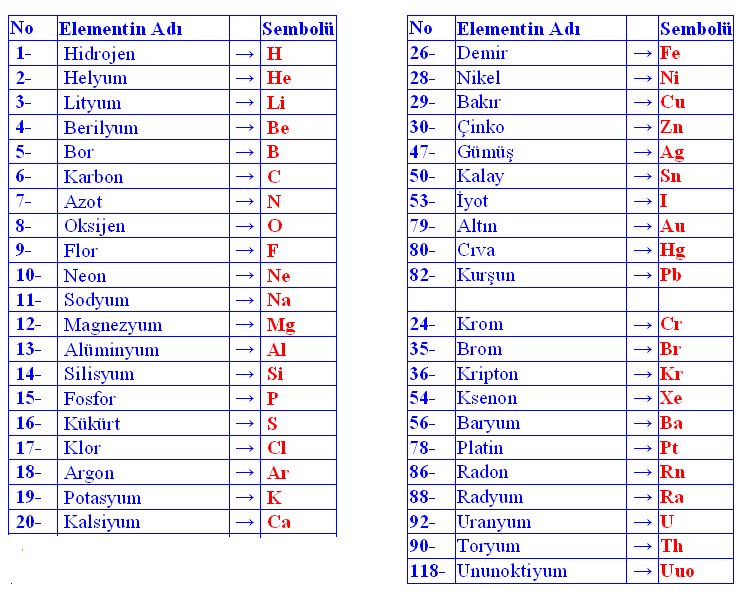
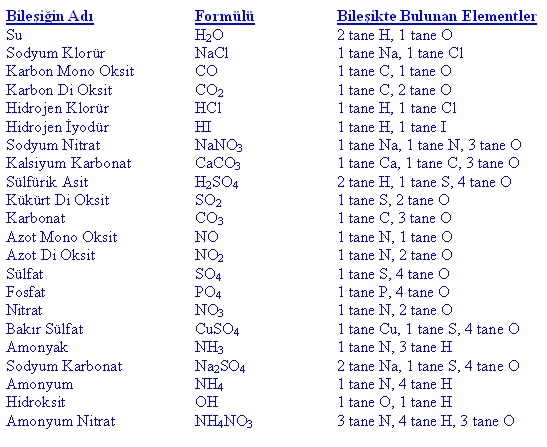
Kim. Element kavramına, maddelerin bölümlenmesi ve çözümlenmesi üzerine yürütülen uzun tarihsel denemeler sonunda ulaşıldı. Doğrudan çözümlemeden, kanşımları arı maddelere ayırmakta yararlanılır; oysa element çözümlemesi, bu karışımları ayrıştırılamayacak düzeyde (en azından kimyasal tepkimelerde kullanılan enerjileri nedeniyle) yalın cisimlere dek indirger. Göreceli olarak çok daha yeni olan bu yaklaşım, XVII. yy.'da, yunan Antikçağı'nda ortaya konan dört element (su, ateş, toprak ve hava) kuramının yerini almıştır. Aristoteles'in onayladığı ve simyacılarca da benimsenen bu kurama göre elementler, maddenin değişik türlerinden çok, ilkel temel maddenin değişik görünümlerini yansıtıyordu. Böyle, artık iyice verimsizleşen bu kavramları bir yana iterek elementi, ayrıştırılamayan bir madde olarak tanımladı Bu düşünceye dayanılarak Lavoisierden günümüze değin elementin, bilinen yüz kadar tanımlaması yapıldı. (KİMYA) Atom kuramı, element kavramına sağlam bir temel oluşturmuştu. Bundan böyle element, tipik kimyasal özellikleri bakımından, yani belli bir biçimlenmeye göre çekirdek çevresine dağılan Z sayıda (atom numarası) elektron kümesiyle belirginleşen atomla özdeşleştirilmiştir. Bir kimyacı için yalnızca nötronlarının (izotoplar) sayısı farklı olan çekirdekler çevresinde aynı elektron biçimlenmesini gösteren çeşitli atomlar, aynı kimyasal elemente girer: çekirdeğin bileşiminin kimyasal özellikler üzerindeki etkisi, pek önemli değildir. Kimyasal simgelemede her elemente 1 ya da 2 harften oluşan bir simge ile bir atom kütlesi verilir.
Elementlerin sınıflandırılması.
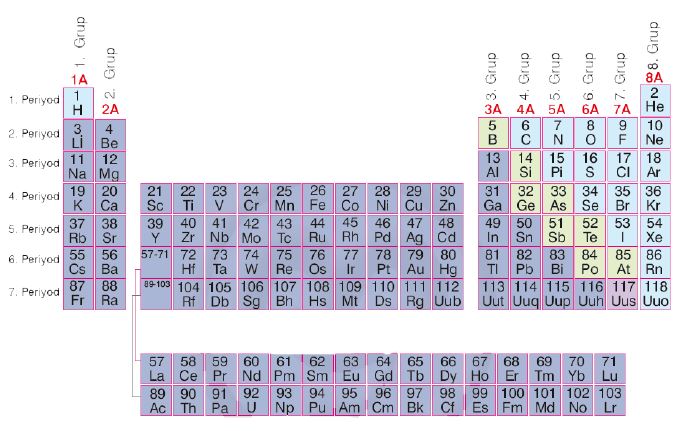
Benzerliklerin saptanması, XIX. yy.'ın başından bu yana üç elementli kimi grupların (üçlü) oluşturulmasına yol açtı. J. B. Dumas (1830), ametalleri doğal ailelerde sınıflandırdı; J. Thenard ise aynı işi metallerle gerçekleştirdi. Ama dönemsellik düşüncesi, ancak A. E. Chancourtois (helisel sınıflandırma) ve J. A. R. Nevvlands (Oktavlar yasası) ile ortaya çıktı. 1869'da L. Meyer, elementleri atom hacimlerine göre sınıflandırdı. Aynı yıl D. I. Mendeleyev, elementler için dönemli bir sistem önerdi: o dönemde bilinen 60 element, kimi evirtimlerle boş bırakılan yerlerin dışında, artan atom kütlelerine göre belirli sayıdaki sıra ve gruplara (kolonlar) yerleştirildi; bu düzenlemede, yalnızca benzer özellikleri içeren elementler aynı grupta yer almıştı. Mendeleyev'in öngördüğü ve yerlerini dönemli tabloda boş bıraktığı elementlerin daha sonraki yıllarda bulunması ve boş bırakılan bu yerlerin doldurulması, bu bilim adamının yaptığı sınıflandırmanın geçerliliğini kanıtlamış ve başarısını pekiştirmiştir.
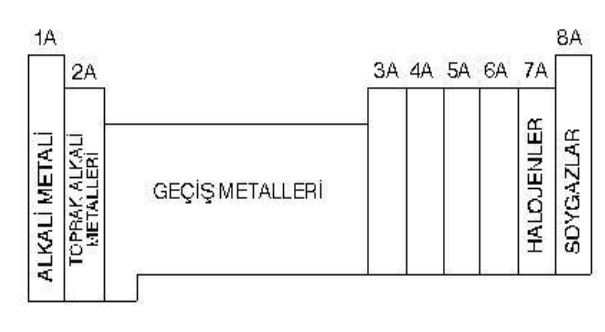
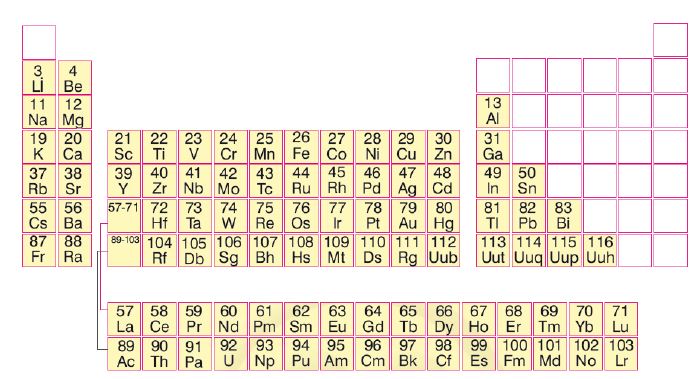
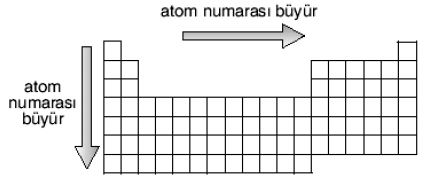
Günümüzde kullanılan sınıflandırmada elementler, artan atom kütleleri yerine atom sayılarına göre sınıflandırılmaktadır: bu da Mendeleyevin yaptığı evirtimleri (Co/Nİ; Te/I; vb.) ortadan kaldırmıştır. En gelişmiş biçimiyle bu tablo, 18 grup (kolonlar) ile artan uzunlukta (2, 8, 8, 18, 18, 32) ve her biri bir soygazla sona eren 7 dönemi (sıra) içerir. Dönemler, elektron katmanlarının gittikçe artan bir biçimde doldurulmasına denk düşer. 4. dönemden başlayarak çeşitli katmanların üst üste binişmesi görülür (ATOM.) Bu tablo, dikey benzerlikleri ortaya kor: I A alkalileri, IIA toprak alkalileri, VII B halojenleri, soygazları; tablonun ortasındaki yatay benzerlikler ise, pek çok sıraya dağılmış geçiş elementlerini (skandiyumdan çinkoya, itriyumdan kadmiyuma, lantadan cıvaya, aktinyumdan lavrenciyuma) gösterir.
Bu geçiş elementlerine tamamlanmamış, ama yavaş yavaş dolan bir d ya da f elektron alt-katmanı (lantanitler ile aktinitler tablonun altına iki dizi halinde yerleştirilmiştir) denk düşer. 4.5. ve 6. dönemlerde, VIII. grubu oluşturan yakın özellikteki metalse! elementlerin meydana getirdiği üçlüler görülür.
Metaller ile ametallerin (sağdan sola ve yukandan aşağıya metal niteliğinin artması) birbirinden ayırt edilmesini sağlayan dönemli sınıflandırma, bir kolondan diğerine element değerliğinin gelişimini de gösterir.
Tarım. Toprağa gübre olarak verilen maddeler kabaca üçe ayrılır:
- besleyici elementler, bitkilerin büyümesi ve gelişmesi için muhakkak gerekli olan ve iyon ya da bileşik halinde alınan kimyasal elementler;
- faydalı elementler, vazgeçilmez olmakla birlikte, bitkilerce yarar için kullanılan kimyasal elementler;
- verim artma elementler, besleyici ya da faydalı elementler; bunlar da 3 gruba ayrılır:
- verim artırıcı önemli elementler ya da makroelementler (azot, fosfor, potasyum);
- verim artırıcı ikincil elementler ya da mikroelementler (kalsiyum, magnezyum, kükürt, sodyum);
- oligoelementler (bor, bakır, klor, demir, molibden, çinko) ve genel olarak, bitkilerin beslenmesine çok ufak dozda katılan cisimler.
Kaynak: Büyük Larousse
Son düzenleyen Safi; 9 Aralık 2016 23:49

 Element Nedir? Elementler Hakkında Genel Bilgiler
Element Nedir? Elementler Hakkında Genel Bilgiler