hidrojen (H)
en basit kimyasal element. Renksiz, kokusuz, tatsız ve yanıcı bir gazdır. Sembol: H
Atom numarası: 1
Atom ağırlığı: 1.00794 g/mol
Oda koşullarında (25°C 298 K)
Bilinen renksiz en hafif gaz
A-metal
s-blok elementi
Hidrojen atomu, birim artı elektrik yüklü bir proton içeren bir çekirdek ile bu çekirdeğin çevresinde dolanan birim eksi elektrik yüklü bir elektrondan oluşur. Hidrojen atomları tepkindir ve çiftler halinde birleşerek hidrojen moleküllerini (H2) oluştururlar. Bolluk bakımından Yerde bulunan elementler arasında dokuzuncu sırayı alır ve Yer kütlesinin yaklaşık yüzde 0,9u hidrojendir. Evrende en bol miktarda bulunan elementtir ve tüm madde kütlesinin yaklaşık yüzde 75ini oluşturur. Hidrojen, karbonla ve öteki elementlerle yaptığı bileşikler halinde bütün hayvansal ve bitkisel maddelerde, ayrıca kömürde ve petrolde bulunur; su kütlesinin de yaklaşık yüzde lli hidrojendir.
Hidrojeni ilk olarak 16. yüzyılda İsviçreli simyacı Paracelsus, asitlerin bazı metaller üzerindeki etkisini araştırırken elde etti. 1766da İngiliz kimyacı Henry Cavendish ise hidrojenin öbür yanıcı gazlardan ayrı bir gaz olduğunu belirledi ve belirli miktarlardaki asitleri ve metalleri tepkimeye sokarak oluşan hidrojenin miktarını ve yoğunluğunu ölçtü. Hidrojenin yanmasıyla su oluşumu 1776da gözlendi. Hidrojen adı 1781de Fransız kimyacı
Antoine-Laurent Lavoisier tarafından önerildi.
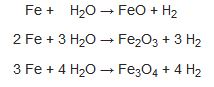
1783te balonlarda hidrojen gazı kullanımı başlatıldı; bu uygulama II. Dünya Savaşına değin sürdürüldü, ama bu arada hava gemilerinde daha çok, hidrojenin tersine yanıcı olmayan helyum gazından yararlanıldı. Hidrojen en çok, bireşim yoluyla amonyak ve metanol üretiminde, petrol ürünü yakıtlarda kükürt giderilmesi işlemlerinde ve bazı rafineri yan ürünlerinden uçucu, kararlı ürünler elde edilmesinde tüketilir.
Aynca, organik bileşiklerin hidrojenlenmesiyle çeşitli sanayi ürünlerinin ve çözücülerin üretiminde, örneğin benzenden sikloheksan elde etmede, hayvansal ve bitkisel yağlardan kahvaltılık ve yemeklik yağlar gibi gıda ürünlerinin hazırlanmasında kullanılır. Hidrojen, klor ve brom ile tepkiyerek hidrojen klorür ve hidrojen bromür oluşturur. Özellikle tungsten ve molibden gibi bazı metaller, oksitlerinin ya da tuzlarının hidrojenle işlenmesi yoluyla elde edilir.
Hidrojenin oksijenle yanması sonucunda yaklaşık 2.600°Clik bir sıcaklık ortaya çıkar; hidrojen moleküllerinin bir elektrik arkı ya da akkor bir tungsten teli yardımıyla ayrıştırılması sonucunda oluşan hidrojen atomlarının yeniden birleşmesiyle de 3.400°Cnin üzerinde sıcaklıklar elde edilebilir.
Az miktarlarda hidrojen elde etmek için çoğunlukla çinkonun sülfürik asitle işlenmesi yönteminden yararlanılır. Sanayi çapındaki üretimde ise, metan gibi bazı hidrokarbonların üzerinden su buhan ya da oksijen geçirilmesi tekniği uygulanır. Hidrojen aynca, çeşitli mayalama ve petrol arıtma işlemlerinde ve elektroliz yoluyla sudkostik ve klor üretiminde yan ürün olarak elde edilir. Hidrojen kimyasal açıdan periyodik tablodaki I. ve VII. grup elementlerine benzer. Metallerle oluşturduğu bileşiklerinde hidrojen atomu ikinci bir elektron alarak eksi yüklü hidrür iyonu (H"), ametallerle yaptığı bileşiklerinde ise elektronunu paylaşarak metan, amonyak, su ve hidrojen klorür gibi ortaklaşım bağıyla bağlanmış moleküller oluşturur. Bazı durumlarda or- taklaşım bağı kolayca kırılır ve böylece ortaya hidrojen iyonu (H+) ile başlangıçtaki molekülün geri kalan bölümünden eksi yüklü bir iyon ortaya çıkar. Özellikle sulu çözeltilerdeki çoğu asidin özellikleri, hidrojen iyonunun varhğından kaynaklanır. Başlıca hidrojen bileşiklerine ilişkin ek bilgi için bak. alkoller; amonyak; hidrokarbonlar; hidrür.
Hidrojen, flüor ile son derece düşük sıcaklıklarda bile şiddetle tepkimeye girerken öbür elementlerin çoğuyla ısı yardımıyla ya da bir katalizör eşliğinde tepkimeye girer.
Hidrojen doğada üç kararlı izotopunun birleşimi halinde bulunur.
- hidrojen-1 (protyum) yüzde 99,985
- hidrojen-2 (döteryum) yüzde 0,015 oranında,
- hidrojen-3 (trityum) ise eser miktarda bulunur. Trityum yapay olarak da üretilebilir, radyoaktiftir ve yan ömrü 12,26 yıldır.
hidrojen iyonu
hidrojen atomunun, çevresinde dolanan elektrondan hidrojen atomunun, çevresinde dolanan elektrondan ayrılmış çekirdeği. Hidrojen atomunun çekirdeği, proton denilen birim artı elektrik yük taşıyan bir parçacıktan oluşur. Bu nedenle, simgesi H+ olan ayrılmış hidrojen iyonu, genellikle protonu göstermek için kullanılır. Yalın haldeki çekirdek elektron, atom ve molekül gibi başka parçacıklarla kolayca birleşebildiğinden, hidrojen iyonu yalnızca içinde hemen hemen başka hiçbir parçacık bulunmayan (yüksek vakum) bir ortamda ve gaz halinde var olabilir.
Günlük kimya dilinde hidrojen iyonu terimi, sulu çözeltilerde H+ H20 molekülü biçiminde birleşmiş halde yer alan hidrojen iyonunu belirtmek için kullanılır.
H+ H20 formülü H30+ olarak da yazılır ve hidronyum ya da oksonyum iyonunu gösterir. Sulu çözeltilerde bulunan hidrojen iyonu miktan, bir maddenin asitliğinin ölçüsünü göstermekte kullanılır. Çözeltinin hidrojen iyonu derişikliği arttıkça asitliği de artar, buna karşılık pHsi düşer.
hidrojen üretimi
Fabrikada
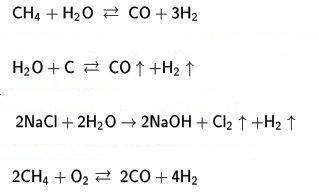
Laboratuvarda

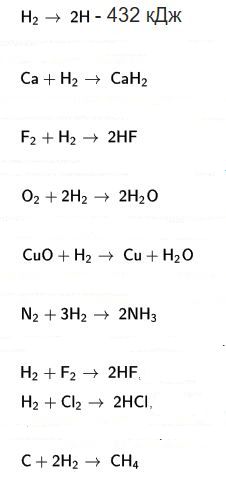
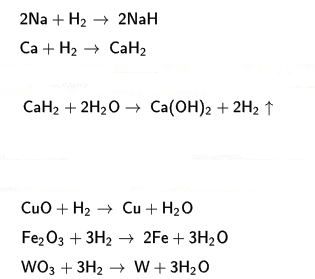
kimyasal özellikler
 BAKINIZ
BAKINIZ
Döteryum Nedir?
Trityum Nedir?
Bileşikler - Hidrojen Peroksit
Bileşikler - Hidrojen Sülfür Bileşikler - Hidroklorik Asit
Bileşikler - Hidrosiyanik Asit Hidrojen Bağı
Önemli İcatlar - Hidrojen Bombası
Su, Suyun Önemi, Kimyasal ve Fiziksel Özellikleri