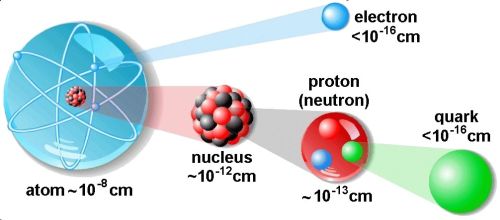
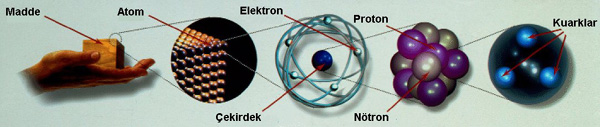
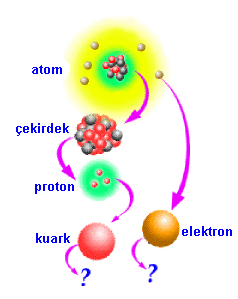
Atom
Maddenin temelinde atom adı verilen çok küçük parçacıklardan oluştuğu kavramı eski yunanlılara kadar uzanır. Milattan önce 5. yüzyılda Leucippus ve Democritus maddenin sonsuz küçük parçacıklara ayrılamayacağını öne sürdüler.Onlar,bir madde daha küçük parçalara bölünmeye devam edilirse en sonunda atomun bölünmeyeceğini iddia ediyorlardı.Atom sözcüğü Yunancada bölünmez anlamına gelen atomos sözcüğünden türetilmiştir.
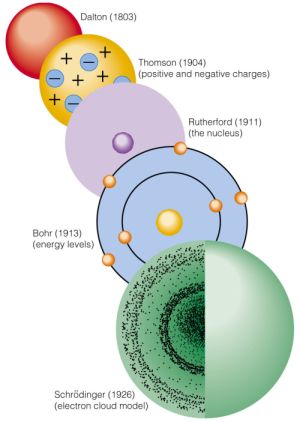
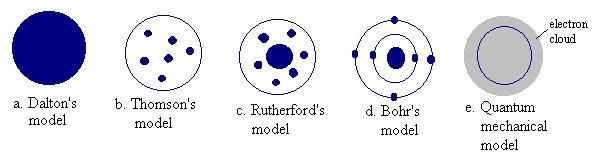
Eski yunan atom kuralları planlı deneylere dayanmıyordu.Bunun için yaklaşık 2000 yıllık bir zaman süresince atom kuramı sadece tartışılmaktan öteye gidilmedi.Atomların varlığı Robert Boyle tarafından THE SCEPTİCAL CHYMİST (1661),Isaac Newton tarafındanda Principia (1687) ve Opticks(1704) kitaplarında kabul edilmişti . Fakat John Daltonun 1803-1808 yılları arasında geliştirip önerdiği atom kuarmı kimya tarihinde en önemli aşamalardan biri olmuştur.
Atom Parçacıkları Elektron:
Gerek Daltonun gerekse yunanlıların kuramlarında atom, maddenin en küçük taneciği olarak kabul edilmişti.19.yüzyılın sonlarına doğru atomun kendisinin de daha küçük taneciklerden oluştuğu düşünülmeye başlandı.Atom hakkındaki düşüncelerde meydana gelen bu değişikliğe elektrikle yapılan deneyler neden oldu.
1807-1808 yıllarında ünlü İngiliz kimyacısı Humphry Davy bileşikleri ayrıştırmak için elektrik kullanarak beş element (potasyum,sodyum,kalsiyum,stronsiyum ve baryum) buldu.Bu çalışmalarına dayanarak Davy , bilesiklerde elementlerin elektriksel nitelikli çekim kuvvetleriyle bir arada tutulduklarını önerdi.
Vakumdan elektrik akımının geçirildiği deneyler 1859 da Julius Plücker katod ışınlarını bulmasına yol açtı.Katot ışnları elde etmek için havası iyice boşaltılmış bir cam tüpün uçlarına iki elektrod yerleştrilir.Bu elektrodlara yüksek gerilim uygulandığında katot adı verilen negatif elektroddan ışınlar çıkar.Bu ışınlar negatif yüklüdür doğrusal yol izler ve katodun karşısındaki tüp çeperlerinin ışık saçmasına sebep olur. 19.yüzyılın son yıllarında katot ışınları ayrıntılı olarak incelendi.Birçok bilim adamının deneyleri sonucunda katot ışınlarının hızla hareket eden eksi yüklü parçacıklar olduğu ortaya çıktı ve bu parçacıklar daha sonra Stoneyin önerdiği gibi elektron adı verildi.
Katottan çıkan elektronlar katot için hangi metal kullanılırsa kullanılsın aynı özelliktedir.Zıt yükler birbirini çektiğinden katot ışınlarını oluşturan elektron hüzmeleri yolları üzerinde üstte ve altta bulunan zıt yüklü iki levha arasından geçerken pozitif yüklüsüne doğru çekilirler.Demek ki bir elektrik alanı içinde katot ışınları normal doğrusal yollarından saparlar.Bu sapmanın açısı :
1. Tanecik yükü ile doğru orantılıdır.Yükü büyük olan tanecik az yük taşıyan tanecikten daha çok sapar.
2. Tanecik kütlesi ile ters orantılıdır.Kütlesi büyük olan tanecik küçük olandan daha az sapar.
Bundan dolayı yükün kütleye oranı bir elektrik alanı içinde elektronların doğrusal yoldan ne kadar sapacağını belirler.elektronlar magnetik bir alan içinde de sapma gösterirler.Fakat bu durumda sapma uygulanan magnetik alana dik yöndedir.
Katot ışınlarının elektrik ve magnetik alanlar içindeki sapmalarını inceleyen Joseph T. Thomson, 1897de elektron için değerini saptadı bu değer:
E/M=-1,7588.10 üzeri sekiz coul /g dır.
Coul uluslar arası sistemde elektrik yükü birimidir.Bir kulon bir amperlik akım tarafından iletkenin belirli bir noktasından bir saniyede taşınan yük miktarıdır.
Elektron yükünün duyar olarak ölçümü ilk defa Robert A. Milikan tarafından 1909 da yapıldı.Milikanın deneyinde x-ışınları etkisi ile havayı oluşturan moleküllerden elektronlar koparılır.Çok küçük yağ damlacıkları da bu elektronları alıp elektrik yükleri ile yüklenirler.Bu yağ damlacıkları iki yatay levha arasından geçirilirler.Yağ damlacıklarının düşüş hızları ölçülerek kütleleri hesaplanır.
Yatay levhalara elektrik akımı uygulandığında negatif yüklü damlacık pozitif yüklü levhaya doğru çekileceğinden damlacığın düşüş hızı değişir.bu koşullar altında düşüş hızı ölçülerek damlacığın yükü hesaplanabilir.Belli bir damlacık bir veya daha çok sayıda elektron alabileceğinden bu yöntemle hesaplanan yükler daima birbirinin aynı değildir.Fakat bu yükler hep belli bir yük değerinin katları olduğundan bu yük değeri bir elektronun yükü kabul edilir.
Proton:
Nötral bir atom veya molekülden bir veya daha çok elektron koparıldığında geriye kalan tanecik koparılan elektronların tolam eski yüküne eşit miktarda artı yük kazanır.Bir neon atomundan bir elektron koparıldığında geriye kalan tanecik koparılan elektronların toplam eksi yüküne eşit miktarda artı yük kazanır.Bir neon atomundan bir elektron koparıldığında bir Ne(+) iyonu oluşur.Bir elektriksel deşarj tüpünde katot ışınları tüpün içinde bulunan gaz atomlarından ve moleküllerinden elektronların çıkmasına sebep oldukları zaman , bu tür artı yüklü tanecikler oluşur.Bu artı yüklü iyonlar eksi yüklü elektroda doğru hareket ederler.Eğer katot delikli bir levhadan yapılmışsa artı yüklü iyonlar bu deliklerden geçerler.katot ışınlarının elektronları ise ters yönde hareket ederler.
Pozitif ışınlar adı verilen bu artı yüklü iyon demetleri ilk defa 1886 da Eugen Goldstein tarafından bulundu.Pozitif ışınların elektrik ve magnetik alanların etkisinde sapmaları ise 1898 de Wilhelm Wien ve 1906 da J.J. Thomson tarafından incelendi.Artı yüklü iyonlar için e/m değerlerinin saptanmasına , katot ışınlarının incelenmesinde kullanılan yöntemin hemen hemen aynısı kullanıldı.Deşarj tüpünde değişik gazlar kullanıldığı zaman değişik tür artı yüklü iyonlar oluşur.
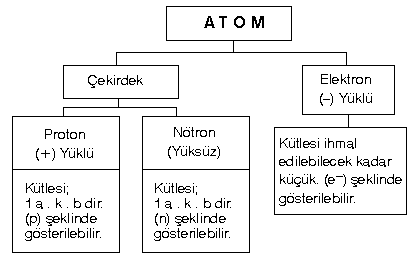
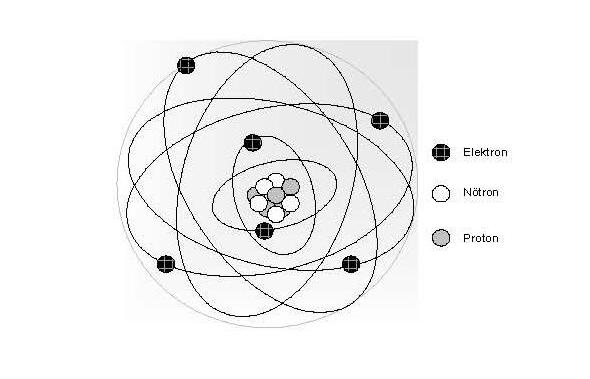
Proton adı verilen bu tanecikler bütün atomların bir bileşenidir.Protonun yüklü elektronun yüküne eşit fakat ters işaretlidir.
Bu yüke yük birimi denir.Proton artı bir elektrik yük birimine , elektron ise eksi bir elektrik yük birimine sahiptir.(Protonun kütlesi elektronun kütlesinin 1836 katıdır).
Nötron:
Atomlar elektrik yükü bakımından nötral olduklarından bir atomun içerdiği proton sayısı elektron sayısına eşit olmalıdır. Atomun toplam kütlesini açıklayabilmek için 1920 de Ernest Rutherford atomda yüksüz bir taneciğin var olduğunu savundu. Bu tanecik yüksüz olduğundan onu incelemek ve tanımlamak zordu. Fakat 1932 de James Chadwick nötronun varlığını kanıtlayan çalışmalarını sonuçlarını yayınladı.Chadwick, nötronların oluştuğu bazı nükleer tepkimelerin verilerinden nötronun kütlesini hesaplayabildi.Bu tepkimelerde kullanılan ve oluşan bütün taneciklerin kütlelerini ve enerjilerini göz önüne alarak Chadwick nötronun kütlesini hesapladı.Bu kütle protonun kütlesinden biraz daha büyüktü.
Günümüzde daha birçok atom altı tanecik bulunmuştur.Fakat bu taneciklerin atom yapısı ile olan ilişkisi çok iyi bilinmemektedir.Kimyasal çalışmalar için atomun yapısı elektron , proton ve nötronun varlığına dayanarak yeterince açıklığa kavuşturulmuştur.
İZOTOPLAR
Belli bir elementin bütün elementlerinin atom numarası aynıdır. Fakat bazı elementler kütle numarası bakımından farklılık gösteren çeşitli tipte atomlardan oluşmuştur.Aynı atom numarasına fakat farklı kütle numarasına fakat farklı kütle numarasına sahip atomlara İZOTOP atomlar adı verilir.
Görüldüğü gibi izotoplar çekirdeklerindeki nötron sayısı bakımından farklıdırlar;bu da doğal olarak atom kütlelerinin farklı olduğu anlamına gelir.Bir atomun kimyasal özellikleri ilke olarak atom numarası ile belirtilen proton ve elektron sayısına bağlıdır. Bundan dolayı bir elementin izotopları birbiri ile hemen hemen aynı olan kimyasal özelliklere sahiptir.Bazı elementler doğada tek bir izotop halinde bulunurlar.Fakat çoğu elementlerin birden çok izotopu vardır.Örnek olarak kalayın 10 doğal izotopu vardır.
Kütle spektrometresi bir elementte kaç izotop bulunduğunu , her izotopun tam olarak kütlesini ve bağıl miktarını saptamak için kullanılır.Buharlaştırılmış madde , elektronlarla bombardıman edilerek artı yüklü iyonlar oluşturulur.Bu iyonlar eksi yüklü bir levhaya doğru çekilerek bu levha üzerinde bulunan dar bir aralıktan hızla geçirilirler.
İyot demeti bundan sonra magnetik bir alan içinden geçirilir.yüklü tanecikler magnetik bir alan içinde dairesel bir yörünge izlerler.Taneciğin yükü arttıkça doğrusal yörüngesinden sapma da artar.Bu nedenle , magnetik bir alanda artı yüklü bir iyonun izlediği dairesel yörüngenin yarıçapı o iyonun e/m değerine bağlıdır.
Değişik e/m değerine sahip iyonların bu son aralıktan geçmesi ise magnetik alan şiddeti veya iyonları hızlandırmak için kullanılan voltaj ayarlanarak sağlanır.Böylece aygıttaki farklı iyon türlerinden her biri bu aralıktan ayrı ayrı geçirilirler.Detektör her farklı iyon demetinin şiddetini ölçer ; bu iyon şiddeti örnekte bulunan izotopların bağıl miktarına bağlıdır.
Atom Numarası ve Periyotlar yasası
19.yüzyılın başlarında kimyacılar elementler arasında bulunan fiziksel ve kimyasal benzerliklerle ilgilendiler.1817 ve 1829 da Johann W. Döbereiner triad lar adını verdiği element serileri (Ca,Sr,Ba;Li,Na,K;Cl,Br,I;S,Se,Te) hakkındaki incelemelerini yayınladı burada her seriyi oluşturan elementler birbirine benzeyen özeliklere sahip olup serideki ikinci elementin atom ağırlığı yaklaşık diğer iki elementin atom ağırlıklarının ortalamasına eşittir.
Bunu izleyen yıllarda birçok kimyacı elementleri benzeyen özellikleri açısından sınıflandırmayı denedi.1863-66 yıllarında John A. R. Newlands oktavlar yasası nı önerip geliştirdi.Newlands a göre elementler atom ağırlıklarının artış sırasına göre dizildiklerinde sekizinci element birinciye , dokuzuncu element ikinciye benziyor ve bu durum böylece devam ediyordu.Newlands bu ilişkiyi müzik notalarındaki oktavlara benzetti.Fakat gerçek ilişki Newlandsın varsaydığı kadar basit değildi.Newlands ın çalışmaları dayanaksız bulunmuş ve diğer kimyacılar tarafından ciddiye alınmamıştır.
Elementlerin modern periyodik sınıflandırılması Julius Lothar Meyer ve özellikle Dimitri Mendeleev in çalışmalarına dayanır.Mendeleev periyodik bir yasa önerdi ; bu yasaya göre elementler atom ağırlığı artışına göre incelendiğinde , özelliklerindeki benzerlikler periyodik olarak tekrarlanır.Mendeleev in çizelgesinde benzer elementler grup adı verilen dikey sütunlarda toplanır.
Ayrıca Mendeleev in çizelgesinde henüz bulunmamış elementler için boş yerler bıraktı ve çizelgede olmayan elementlerden üç tanesinin özelliklerini önceden belirtti.Hemen sonra Mendeleev in öngördüğü özelliklerin çoğuna sahip oldukları belirlenen Skandiyum,galyum ve germanyum elementlerinin bulunması periyodik sistemin doğru olduğunu gösterdi.Asal gazların varlığı Mendeleev tarafından öngörülmediği halde bu elementler 1892-98 yılları arasında bulunduktan sonra periyodik çizelgedeki yerlerine oldukça iyi bir şekilde uydular.
Periyodik çizelgedeki plana göre K, Ni ve I elementlerinin atom ağırlığının artışına göre belirlenmiş dizilişinin dışında yer almamaları gerekliydi.Örneği iyot atom ağırlığına göre 52 numaralı element olmalıydı.Fakat kimyasal açıdan benzediği F,Cl ve Br elementleri ile aynı gurupta olabilmesi için iyot keyfi olarak 53 numaralı element oldu.Periyodik sınıflandırmanın daha ayrıntılı olarak incelenmesi ile bir çok araştırıcı periyodik özelliğin,atom ağırlığından çok , başka bir temel bağlı olduğuna inandı.Bu temel özelliğinde o zamanlar periyodik sistemden çıkarılan ve sadece bir seri numarası olan atom numarası ile ilişkisi olduğunu öğrendi.
1913-14 yıllarında Henry G. J. Moseley in çalışmaları bu problemleri çözdü.Yüksek enerjili katot ışınları bir hedefe odaklandığında X-ışınları oluşur.Bu X-ışınları çeşitli dalga boylarındaki bileşenlere ayrılabilir ve bu şekilde elde edilen çizgi spektrumları da fotografik olarak kaydedilebilir.Hedef olarak değişik elementler kullanıldığında değişik X-ışınları spektrumları elde edilir ve her spektrum sadece birkaç karakteristik spektral çizgi içeren X-ışınları spektrumu vardır.
Moseley atom numaraları 13 ile 79 arasında olan 38 elementin X-ışınları spektrumunu inceledi.Her elemen için o elemente karşılık gelen karakteristik spektrum çizgisini kullanan Moseley , elementin atom numarası ile çizgi frekansının kare kökü arasında doğrusal bir ilişki olduğunu buldu.Başka bir değişle elementler atom numarası artışına göre dizildiğinde spektrum çizgisi frekansının karekökü bir elementten diğerine gittikçe sabit bir miktarda artar.
Bundan dolayı Moseley X-ışınları spektrumuna dayanarak elementlerin doğru atom numaralarını tahmin edebildi.Böylece atom ağırlıkları komşu atomlarınkine uygun düşmeyen K,Ni ve I un sınıflandırılması problemi de çözümlenmiş oldu.Diğer taraftan Moseley Ce den Lu e kadar olan seride 14 element bulunması ve bu elementlerin ve bu elementlerin periyodik çizelgede Lantandan sonra gelmeleri gerektiğini bildirdi.Moseleyin diagramları ayrıca 79 numaralı elementten önce henüz o zamana kadar bulunmamış 4 elementin var olması gerektiğini de gösterdi.Nihayet Moseleyin çalışmalarına dayanarak periyodik yasa Elementlerin fiziksel ve kimyasal özellikleri atom numarasının periyodik fonksiyonudur şeklinde tekrar tanımlandı.
Moseley in atom numaraları ile Rutherford un tanecikleri saçılma deneyinden hesapladığı çekirdek yükleri oldukça iyi bir uyum içindeydi.buna dayanarak Moseley atom numarasının atom çekirdeğinde bulunan artı birimlerin sayısı olduğunu önerdi.
Moseley ayrıca, atomda bir elementten diğerine gidildikçe artan temel bir nicelik bulunduğunu ifade ederek bu niceliğin ancak merkezdeki artı yüklü çekirdeğin yüklü olabileceğini belirtti.
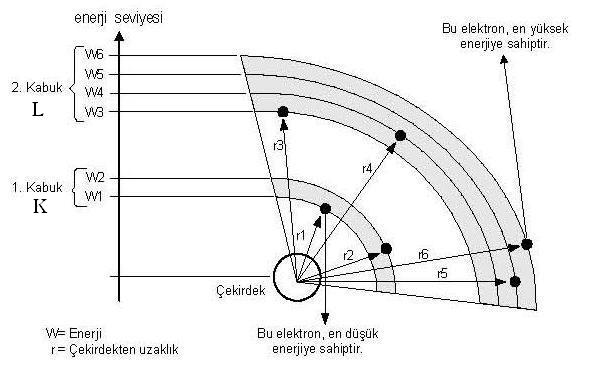
X-ışınları , görünür ışıktan çok daha kısa dalga boylarına ve dolayısıyla daha yüksek frekans ve enerjilere sahip elektro magnetik ışınlardır.Bir elementin x-ışınları spektrumunun olmasına hedef element atomlarında meydana gelen elektron geçişlerinin sebep olduğuna inanılmaktadır.X-ışınlar tüpüne katot ışınları , hedefteki atomların iç kabuklarından elektronlar koparırlar.Dış kabuktaki elektronlar iç kabuklarda oluşan bu boşlukları doldurdukları zaman x-ışınları yayınlanır.Bir atomda elektronun , yüksek bir enerji düzeyinden K düzeyine geçmesi sonucu oldukça bir büyük bir miktarda enerji açığa çıktığından , elde edilen radyasyonun frekansı yüksektir.Buna karşı gelen dalga boyu da x-ışınlarına özgü olup kısadır.
Bir elektron geçişi sırasında açığa çıkan radyasyonun frekansı ayrıca atom çekirdeğindeki yüke bağlıdır.Açığa çıkan bu enerjinin miktarı çekirdek yükünün karesi ile doğru orantılıdır.Çekirdeğin yükü arttıkça açığa çıkan enerji artar ve yayınlanan radyasyonun dalga boyu kısalır.Moseley in gözlemleri de bu ilişkiyi yansıtmaktadır.


 Atom Nedir? Atom Hakkında Genel Bilgiler
Atom Nedir? Atom Hakkında Genel Bilgiler